His tag堪称纯化标签一哥,我想没有人会站出来反对。做蛋白亲和纯化的人就没有没听过His名号的。
我们稀里糊涂跟它打交道了很多年,有天突然就想一个问题:
这货当初是怎么来的?
是谁发明了它?
时代的呼唤!!!
在上世纪70年代,蛋白质的分离和纯化技术相对有限,需要新的方法来提高分离效率和纯度。
01
His tag用于蛋白纯化的思想启蒙
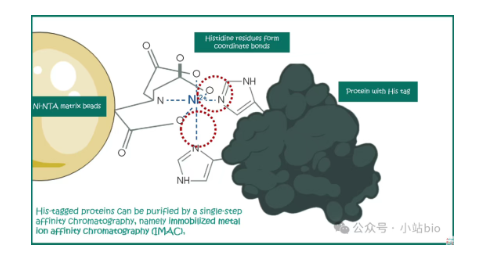
1975年, J. Porath等人的研究论文中,实验者将金属螯合亲和层析(Metal chelate affinity chromatography, 简称MCAC)技术应用于蛋白分离【1】。研究者首先将金属离子(如Cu2+、Ni2+等)固定到IDA-衍生的凝胶上,形成金属螯合亲和层析介质。利用这种介质,研究者进行了蛋白质的吸附实验,探究不同蛋白质与金属离子的亲和性。实验发现,某些蛋白质可以特异性地结合到固定化的金属离子上,而其他蛋白质则没有这种结合能力。通过改变溶液的pH值或使用竞争性配体,可以有效地从亲和层析介质上洗脱结合的蛋白质。
这项技术利用了蛋白质上的某些氨基酸残基(如组氨酸、半胱氨酸、赖氨酸等)与金属离子(如镍、铜、锌等)的亲和作用,通过这些金属离子固定在带有亚氨基二乙酸(iminodiacetic acid, IDA)或其他配体的树脂上,实现对蛋白质的亲和层析。
这项研究成果的发表标志着亲和层析技术在蛋白质分离领域的应用迈出了重要的一步。它不仅为后来的研究人员提供了一种新的蛋白纯化实验方法,而且为理解蛋白质结构和功能提供了新的视角。
02
His tag的雏形
1988年,Smith等人提出了在蛋白质N-末端添加特定的金属螯合肽(Chelating Peptide, CP),以增强其与固定金属离子的结合能力,从而提高纯化效率。这种方法被称为CP-IMAC,它通过在目标蛋白质上引入一个CP序列,使得蛋白质能够通过IMAC被特异性地纯化【2】。
实验人员设计了螯合肽His-Trp与促黄体激素释放激素(LHRH)类似物2-10 LHRH的N-末端融合表达,结果融合蛋白可以与Ni2+形成配位复合物并具有高亲和性。此外,实验人员设计了His-Trp-胰岛素原作为重组CP-蛋白质模型,利用该模型研究了其在大肠杆菌中表达,研究其与固定化Ni2+的结合和洗脱情况。
03
His tag的发展
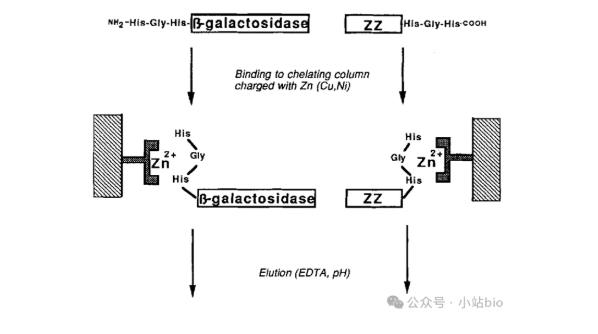
1989年,瑞典斯德哥尔摩皇家理工学院生物化学与生物技术系Ljungquist C等人也利用基因融合方法,将目标蛋白的基因与编码亲和肽段Ala-His-Gly-His-Arg-Pro的基因片段融合,为了使表达的融合蛋白可以与固定化金属离子(Zn2+)结合而利用亲和色谱法(IMAC)进行纯化,研究者合成了编码亲和肽段的连接体,以上述编码亲和肽段为基本单位,分别做两次,四次串联聚合,这样制备出分别含有2个、4个和8个His氨基酸的亲和肽段,然后将这肽段与编码双结构域蛋白A分子ZZ的基因的3'端和编码β-半乳糖苷酶的基因的5'端融合。研究发现,不含有或两个His的亲和肽段的融合蛋白与固定化Zn2+的结合能力较弱,而含有4个或8个His的亲和肽段的融合蛋白则显示出较强的结合作用。通过pH梯度改变,发现ZZ融合蛋白可以根据亲和肽His的数量多少在不同的pH值下从树脂上洗脱,His数越多,结合力越强,洗脱的pH值越低【3】。
His-Gly-His 这样的结构,可对Co2+,Ni2+ 和 Cu2+有高亲和力,但是我们发现实验人员紧随其后连接一个Arg,其目的是为了增加正电荷,该标签不但可以用于亲和层析,还能用于离子交换纯化。随着亲和肽重复数的增加,其pI(Isoelectric point,蛋白质等电点)值不断升高,这与Arg有关,精氨酸的设计就是为了调节pI;研究人员紧随其后还加了一个Pro,原来胰蛋白酶样蛋白酶在哺乳动物、人和细菌中都广泛存在,偏好切割碱性氨基酸后面的肽键,如果在碱性氨基酸后面紧接着一个Pro,则可以大大减少该酶对肽键的降解。
另外,研究人员还发现,如果亲和肽标签放在N-端,β-galactosidase局有完全酶活性,但如果放在c-端其活性将大大降低。这就提示我们,标签位置很重要。
这是1989年的一篇文献,足以看出本文作者扎实的生化专业功底。读完这篇文献,我们再利用His标签进行蛋白纯化的时候,不应该只会简单利用现有质粒载体上的6XHis了,更不应该遇到6XHis标签纯化不下来的蛋白,直接粗暴加长到8XHis,甚至12xHis;不但如此,我们还要牢记标签的位置很重要,虽然说放在目标蛋白的N-端或者C-端都可以,甚至是蛋白结构凸起的序列内,标签位置对后续的纯化影响很大,对蛋白活性影响更大。
至于这篇文章中为什么用Zn2+,而不是用Ni2+,我还没有找到答案,可能是Zn2+结合力弱于Ni2+,洗脱条件会更温和一些,利于保护蛋白质活性。
这篇1989年的文章信息量之大,含金量之高,时至今日,仍具有很大的参考价值。
04
6XHis tag的确立
说到这里,我们还有一个问题,为啥那些商业化载体上大部分是6XHis标签,这个“6”是怎么来的?
1988年,Hochuli等人以小鼠二氢叶酸还原酶(Dihydrofolate reductase, DHFR)为演示蛋白分别在其N-端和C-端融合2-6个His,然后将这系列蛋白在大肠杆菌里表达,通过Ni2+-NTA亲和纯化研究。研究结果表明,只有当His个数达到6的时候,重组蛋白在6M GuHCl的溶液里,才能达到90%以上的结合效果。也就是说6XHis tag可以在大多数相对极端环境(比如盐酸胍)下保证重组蛋白与Ni2+-NTA亲和填料的最佳结合效果【4】。当然,在PBS溶液中,2-4个His标签都会有很好的结合率;实验数据还表明,相同数量的His标签,在N-端和C-端,其结合效果还是很有差异的,上文我们也提到了,His标签放在不同的位置,不但会影响其活性还会影响其与Ni2+-NTA的结合效率。
05
His tag的位置问题
His tag通常被设计融合在目标蛋白的N-端或C-端,目标蛋白与His tag之间还设计一段短的柔性多肽连接,这个短肽间可包括一个蛋白酶的切割位点(比如,TEV酶,肠激酶EK,等)。很少将标签设计在蛋白序列的内部,偶尔也有设计在蛋白突出的环凸中。His标签的位置需要基于蛋白的特性考虑,有时可能需要设计多个不同标签位置的构建体进行测试,从中优选。 尽管实验人员普遍认为His tag比较小,不会影响蛋白的特性,但是文献数据和我们的实验案例证据都显示,His-tag的添加对很多蛋白都有负面的影响,比如改变蛋白的聚集状态,改变等电点,改变抗原的免疫原性和反应原性,影响蛋白质的酶活性,影响溶解度等等。
06
用于His tag融合蛋白纯化的固相组成
所谓固相组成就是我们常说的纯化填料,包括固相基质、螯合剂和金属离子。
市场上最常见的固相基质主要有交联琼脂糖(sepharose)、交联葡聚糖(sephadex)、大孔硅胶及一些有机聚合物等,近些年,磁珠也很流行。
至于螯合剂,亚氨基二乙酸 (iminodiacetic acid,IDA) 和氮三乙酸 (nitrilotriacetic acid,NTA) 的衍生物最常用,除此之外,还有N,N,N-三(羧甲基)乙烯二胺(TED)、四乙烯戊胺(TEPA)、羧甲基α,β-二胺丁二酸(CM-DASA)和乙二胺N,N-二乙酸(EDDA)等。
常用的金属离子有:二价阳离子 Cu2+、Ni2+、Fe2+、Zn2+、Co2+等过渡金属离子。金属离子与螯合剂作用时,一般形成五元环或六元环,结构更稳定,且环数目越多结构越稳定。
那么多金属离子,为啥Ni2+受偏宠?
金属阳离子的选择通常是结合能力和纯度之间的折衷。Ni2+比较中庸,因为它在这些因素之间提供了最好的平衡,而Co2+对His tag结合能力稍低,对内源性蛋白质的亲和力也较低,常常用于高纯度蛋白的提取纯化。
07
His tag融合蛋白洗脱方法
利用His tag纯化蛋白,从固相载体洗脱His tag融合蛋白,最常用的有三种方法,常常将这三种方法组合使用。为了避免蛋白质变性和功能失活,尽可能选用温和的方法。
1.类似物竞争洗脱
为了使His-tag 融合蛋白从载体上释放,可以使用一种与 His-tag类似结构的化合物,该化合物也与固相载体上的金属离子形成配位复合物,将His-tag融合蛋白从固相载体上竞争下来,咪唑是组氨酸的侧链,也就是我们在做His tag融合蛋白纯化最为熟悉的洗脱试剂,通常以150 - 500 mM 的浓度用于洗脱,也可以使用组氨酸或组胺。
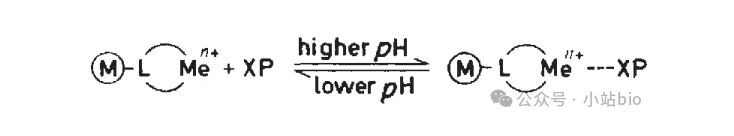
2.pH值降低
当 pH 值降低时,His残基被质子化,不再能与金属离子配位,从而使蛋白质被洗脱。当使用Ni2+作为金属离子时,它在 pH 值 4 左右洗脱,而Co2+在 pH 值 6左右洗脱。随着His个数增多,其洗脱的pH也越低。
3.金属离子螯合去除
强螯合剂(如 EDTA)可以直接螯合”抢走”通过螯合剂固定在固相载体上的金属离子,因此蛋白质会从固相载体上脱离。目前,有些商业化公司已经开发出可以耐受EDTA的填料。
以上三种洗脱方法,第一种最温和,是目前最常用的标准洗脱方法,当然,洗脱剂不仅限于我们耳熟能详的咪唑,还可以用组氨酸或者组胺;第二种最生猛,低pH溶液强酸溶液环境会对蛋白造成不可逆的损伤;第三种属于杀鸡取卵,强行将金属离子从固相载体上剥脱下来,这个填料就废了,不能再次使用,如果想要再次重复使用这个填料,需要重新加金属离子,也就是所谓的重生,再次重生的填料在效果上肯定不如原装出厂的纯化效果好。
08
His tag用于重组蛋白纯化
His tag非常广泛地应用于重组蛋白表达纯化,可以说是蛋白纯化领域最亮的崽。
目前,很多商业公司研发出His tag融合重组蛋白表达纯化系统的系列产品,从重组蛋白表达载体构建到纯化填料,以及该系列产品的标准化操作流程,都有保姆级的使用教程和非常完善的指导体系。
但是,这些流程只对初学者扫盲有用,真正的有经验的蛋白纯化人员不应仅仅拘泥于此。一分钟学会的如此简单His tag重组蛋白纯化技术,遇到的问题大抵是让你一年欲哭无泪,爱而不得:明明看到蛋白表达,却是纯不下来,或者纯下来的杂蛋白比目标蛋白还多,喧宾夺主。
这些商业化的表达载体上的蛋白表达单元框内一般会设计连续的6个His(6xHis)在N-端或者C-端,或者两端都有;当我们将目标蛋白基因通过多克隆位点(Multiple Cloning Site, MCS)插入达到表达载体的时候,可以构建出N-端、C-端或者两端都带6xHis标签的融合蛋白。
基因合成技术如此发达的今天,谁还过度依赖于载体上那几个His标签的有无和位置,目标基因的插入谁还拘泥于多克隆位点的那几个限制酶切位点憋屈,谁还局限于那老套的6XHis?
在此基础上,研究人员设计出各种His tag的衍生玩法。
HQ tag
HQ tag标签的序列是HQHQHQ,是在6XHis tag的基础上间隔着将氨基酸His改编为Gln, Becky Godat,等人在2008年的《 Affinity Chromatography_ Methods and Protocols》这本书的一个章节里描述了这个标签,书中没有明确指出它比6XHis tag优势之处,但如果非要找出其优势点:分子量更小,在更低的咪唑浓度(50mM)浓度下可以洗脱HQ tag融合目标蛋白,低浓度的咪唑对蛋白更友好(高浓度的咪唑更容易使蛋白质聚集),也更利于目标蛋白的下游实验,特别是酶活实验【5】。
携带HQ tag的商业化载体Flexi® Vectors出自promega这个公司,百度搜索关键词“HQ tag”,搜索结果第一条就是promega公司的Flexi® Vectors信息。
6XHN tag
6X HN标签(HN tag)是His与Asn形成小单元(HN)连续重复6次,即(HN)6,它与6XHis标签相比,其与金属离子结合力更强一些,关于这个标签的文献相对较少。
Clontech(Takarabio)公司研发出pET6xHN Expression Vector产品,并申请了相关专利,专利号US7176298。
HAT tag
HAT tag是一种新型阳离子亲和标签,源自鸡乳酸脱氢酶,氨基酸序列为KDHLIHNVHKEEHAHAHNK,它包含六个His,与其他氨基酸残基不均匀交错分布。HAT tag与 His tag相比,它是一种无电荷分布偏差的可溶性蛋白质,因此,HAT tag融合蛋白具有更好的溶解性。不但如此,HAT tag中His的不均匀交错排列使其具有更高的可及性,能更有效与固定化的金属离子结合。HAT tag融合蛋白可以在中性pH下与固定化的金属离子结合吸附,此中性溶液环境下,细胞裂解物中存在的碱性蛋白酶活性较低,利于大多数蛋白质稳定和活性保持。
HAT被Clontech(Takarabio)注册了商标,其公司也开发出HAT蛋白表达及纯化系统系列产品,又是保姆级教程【6】。
【小结】
His tag用于纯化的前景展望
重组蛋白纯化就像黑夜,目前已经发现或者发明的标签充其量也只是夜空里的星星而已,还有更多的未知需要我们去摸索。使用商业化的系统进行蛋白表达纯化,我们可能只知道6X His标签,甚至8X His标签,对应的纯化填料也就只知道Ni2+亲和树脂,至于标签的融合位置,我们往往也只考虑融合在目标蛋白的N-端或者C-端,或者两端都融合。其实,His tag不仅仅局限于6X His tag,8X His tag,HQ tag,HN tag,HAT tag,你还可以根据目标自身的特征自由发挥,为其量身定制。自由设计His tag你不但需要考虑其融合位置,还要全方位考虑其电荷性,亲水性,可及性,酶切位点,水解稳定性等等因素,所有的小心翼翼,都是为了给目标蛋白的纯化过程一个更易获取的方案、给蛋白一个更舒适的环境。基因合成技术如此发达的今天,你所设计的序列将不受限于目前这些商业化载体的所谓多克隆位点和现有标签的框框,一言不合就全基因合成。
至于商业化的配套的纯化产品,最常用的就是Ni2+填料,次常用的还有上文提及的Co2+和Cu2+。保姆级教程中,洗脱液中最常用的还是咪唑,其实,洗脱剂不仅限于咪唑,组胺衍生物都应该可以,比如组氨酸和组胺。关于纯化填料树脂,我不太了解,在此不敢多言。
His tag在蛋白纯化领域的应用,其序列和结构形式上的设计远远不止于上述所提及的这些。七八十年发明这个标签的几篇最原始的文献,已经告诉了我们His tag最底层的逻辑,只是随着技术的发展,勤快的商业化公司制造出一些比较好用的懒人工具,让大部分人只知道6 X His和Ni2+树脂填料。
未来利用His tag进行蛋白纯化,肯定需要考虑比上述所提及的更多因素,而考虑这些因素仅仅靠人工数着氨基酸去琢磨肯定不行,必然需要借助于计算机设计出最佳的His标签。
在应用领域上,His tag不仅限于蛋白纯化,还可用于荧光标记示踪,Pull down实验和免疫检测等。选择合适的螯合剂与荧光素偶联,只需要在目标蛋白上设计合适的His tag,就可以实现对目标蛋白的示踪定位。Pull down实验其实跟His tag蛋白纯化原理差不多。至于免疫检测,除了目标蛋白融合上合适的His tag外,还需要特异性的抗体配合,目前,针对His tag,HN tag,HAT tag,市面上都有物美价廉的商业化产品。
一个男人成功的背后,一定站着深明大义的女人。
His tag 的辉煌,同样离不开二价阳离子们的默默付出。His tag 与 Ni2+ 的关系,就如同天作之合,虽然偶尔也会与 Co2+、Cu2+、Zn2+ 等其他阳离子搞个暧昧,但这些都无法与 Ni2+之间的深厚情谊相提并论。像这样的神仙眷侣还有很多,比如:蛋白酶与蛋白酶抑制剂,凝集素与糖蛋白,受体与配体,酶与底物,当然不能少了最耀眼的生物素与亲和素。
标签故事诸多,后续笑谈中
